Le projet PANAFPOX, un projet multidisciplinaire avec une approche One Health, a pour but d’apporter de nouveaux éclairages sur le mpox dans 4 pays d’Afrique, endémiques pour le mpox (République démocratique du Congo, Cameroun) ou à haut risque d’émergence (Bénin, Guinée). Si l’épidémie mondiale de variole du singe n’est plus une urgence de santé publique, de nombreuses inconnues persistent sur cette zoonose.
Par Camille Besombes, Martine Peeters, TransVIHMI
Afrique Covid-19 et maladies émergentes One Health Variole du singe
Le 11 mai 2023, après un an d’épidémie mondiale de variole du singe (renommée mpox) ayant causé plus de 87 000 cas humains confirmés, l’OMS vient d’annoncer que le mpox n’est plus une urgence de santé publique de portée internationale, devant une épidémie en diminution dans le monde occidental.
Cependant la réalité épidémiologique est tout autre dans les pays endémiques en Afrique, qui font face à une expansion préoccupante de la maladie, à une létalité non négligeable, et à une absence d’accès à la vaccination préventive1, soulignant une fois encore les déséquilibres de considération mondiale selon les populations et territoires touchés. L’apparition d’une épidémie mondiale de mpox en mai 2022 a mis l’éclairage sur cette zoonose relativement mal connue, malgré la découverte du premier cas humain en 1970 en République démocratique du Congo. Cette maladie qui s’est manifestée en Occident par une prédominance de lésions génitales suite à des transmissions interhumaines, est avant tout une zoonose pour laquelle persistent beaucoup d’inconnues autour de son réservoir épidémiologique, des potentiels hôtes animaux impliqués dans la transmission, et des modes exacts de transmission zoonotique et interhumain; nécessitant l’accentuation des recherches notamment dans les pays endémiques en Afrique. Notre projet PANAFPOX: une approche One Health du mpox en Afrique centrale et de l’ouest propose au contraire d’accentuer les recherches notamment dans les pays endémiques en Afrique.
La variole du singe ou mpox
Le mois de mai 2022 a été le témoin de la dissémination mondiale du virus monkeypox2 aboutissant à la déclaration d’une urgence de santé publique de portée internationale par l’OMS le 23 juillet 2022. Le mpox —nouveau nom de la maladie préconisé par l’OMS en novembre 2022— est une zoonose émergente, préalablement limitée aux zones forestières d’Afrique centrale (clade Bassin du Congo/clade I) ou de l’ouest (clade Afrique de l’ouest/clade II). Le Cameroun étant le seul pays avec une cohabitation des clades I et II. La maladie se manifeste par un syndrome fébrile, des lésions maculo-papulaires sur l’ensemble du corps, la présence d’adénopathies importantes, et une létalité non négligeable allant de 1 à 11%, particulièrement pour le clade I. En Afrique, il est jusqu’alors considéré que la transmission zoonotique est prédominante dans l’épidémiologie du mpox, par rapport à une transmission interhumaine dont l’implication est difficile à évaluer3.
Depuis son émergence en République démocratique du Congo (RDC) en 1970, on constate une majoration du nombre et de la fréquence des épidémies. Cette évolution est mise en lien avec, d’une part la baisse progressive de l’immunité croisée avec la variole, suite à son éradication et à la fin de la vaccination contre la variole en 1980, également avec une majoration de la surveillance et des capacités diagnostiques, et d’autre part avec les changements écologiques majeurs (déforestation, urbanisation, changement d’usages des terres, changements démographiques, etc.) engendrant une perte massive d’habitat de la faune sauvage et une majoration des interactions humains/animaux4.


Lésions cutanées d’un cas humain de mpox – République démocratique du Congo – Mai 2023
Crédit photographique : Dr François Kasongo
L’épidémie mondiale de 2022 a été caractérisée par une circulation interhumaine soutenue suite à des contacts par voie cutanée lors des rapports sexuels, avec une présentation atypique sous la forme de lésions génitales. Le clade viral en cause est relié avec le clade II circulant au Nigéria, et plus récemment impliqué lors des cas humains exportés à Singapour, Israël et Royaume Uni (2017-2019). En 2022, la mise en évidence de l’accumulation de mutations en lien avec l’action de l’enzyme APOBEC 3 sur les génomes étudiés, signalait l’adaptation du virus à un nouvel hôte témoignant de cette circulation interhumaine5.
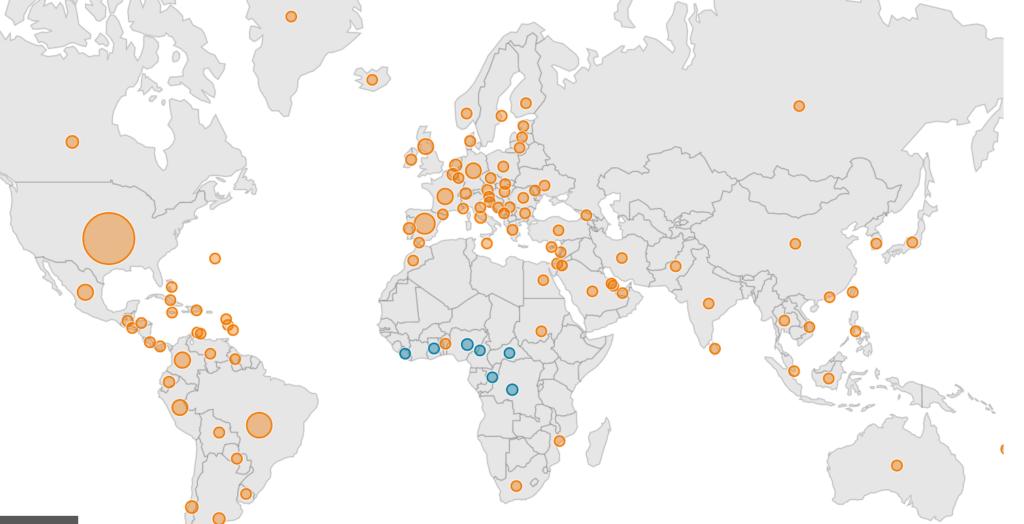
Répartition mondiale des cas humains de mpox en zone endémique (bleu) et en zone non endémique (orange). Date : 17/05/2023.
Afin de tenter de comprendre le mpox mais plus largement, face aux multiples émergences infectieuses récentes (Ebola, Sars-CoV-2, Lassa, grippe aviaire), une réflexion globale sur les causalités systémiques de ces zoonoses émergentes est nécessaire: l’approche One Health permet une approche intégrée des liens complexes entre la santé humaine, la santé animale domestique et sauvage, la santé des végétaux, et la santé des écosystèmes. Malgré plusieurs décennies de présence de cette maladie sur le continent africain, nos connaissances sur le mpox sont encore très incomplètes. Le réservoir animal, les facteurs de transmission zoonotique et interhumaine et les facteurs écologiques et anthropiques d’émergences, ou la fréquence des formes asymptomatiques, n’ont pas été formellement identifiés, nécessitant de renouveler les hypothèses de recherche autour de cette zoonose à l’interface humains/animaux/environnements.
Le projet PANAFPOX
C’est dans ce contexte que s’est créé le projet PANAFPOX, un projet multidisciplinaire avec une approche One Health ayant pour but d’apporter de nouveaux éclairages sur le mpox dans 4 pays d’Afrique, endémiques pour le mpox (République démocratique du Congo, Cameroun) ou à haut risque d’émergence (Bénin, Guinée), pour documenter l’extension de l’infection par le virus mpox en populations humaines et animales, et évaluer le risque épidémique et de dissémination mondiale de cette zoonose émergente, notamment du clade I.
Ce projet s’intéresse à la compréhension du mpox à l’échelle de l’Afrique, en mettant en réseau plusieurs pays impliqués dans de précédentes collaborations avec des expertises préalables en matière d’approche One Health:
La République démocratique du Congo (RDC) est endémique pour le mpox, avec plus de 1 000 cas suspects/an depuis 2005 et regroupant 95% des cas humains de mpox mondiaux jusqu’à 2022. Le nombre de cas suspects annuels augmente chaque année avec déjà 2 061 cas suspects notifiés dans les 4 premiers mois de 2023. Le virus a également été identifié chez des animaux en RDC. L’INRB (Institut national de recherche biomédicale) est le laboratoire de référence de plusieurs maladies infectieuses émergentes en RDC dont le mpox et Ebola. Le centre de surveillance de la biodiversité de Kisangani travaille sur les liens entre biodiversité et maladies infectieuses émergentes dans le bassin du Congo.
Au Cameroun, des cas humains de mpox ont été rapportés, d’une part dans les provinces frontalières avec le Nigéria impliquant le clade II, et d’autre part dans l’est et le centre du pays impliquant le clade I, et plusieurs épizooties ont également été reportées chez des chimpanzés dans des sanctuaires. La coexistence des deux clades viraux faisant de ce pays un endroit particulièrement intéressant à étudier. Le CREMER (Centre de recherche sur les maladies émergentes et réémergentes) est un laboratoire de référence pour les investigations One Health.
Au Bénin, des cas humains ont été déclarés en juin 2022, dans la région de Pobé, zone frontalière avec le Nigéria, ce pays faisant également partie de la niche écologique de certains hôtes animaux du virus mpox6. Le LNFHV (Laboratoire national des fièvres hémorragiques virales) est le laboratoire de référence pour le diagnostic des maladies infectieuses émergentes au Bénin.
Aucun cas de mpox n’a été recensé en Guinée, mais le profil écologique du pays en fait une zone potentielle d’émergence comprise dans la niche écologique du virus monkeypox7, et tous les pays frontaliers ont déclaré des cas humains. Le CERFIG (Centre de recherche et de formation en infectiologie de Guinée) est un centre expert en approche One Health en Guinée, notamment sur Ebola.
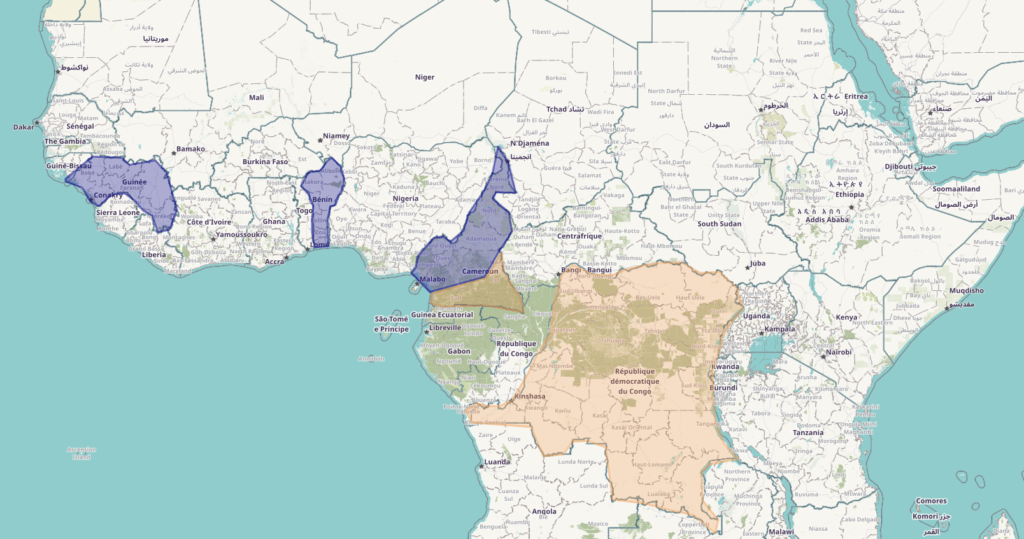
Pays concernés par le projet PANAFPOX : clade I du virus monkeypox (orange) et clade II du virus (violet)
Ce projet PANAFPOX repose sur plusieurs axes de recherche complémentaires et articulés :
– Recherche du réservoir animal du virus monkeypox
Si le virus monkeypox a été identifié pour la première fois chez un macaque captif à Copenhague en 1959, l’étude de cette zoonose depuis plusieurs décennies, n’a pour l’instant pas permis d’identifier les réservoirs et hôtes animaux du virus. Le virus a été formellement identifié chez un écureuil (Funisciurus anerythrus) en RDC dans les années 1980, chez un singe mangabey et sur desfèces de chimpanzé dans le parc national Taï en Côte d’Ivoire plus récemment8. Cependant les primates sont considérés comme des hôtes accidentels et ce sont plutôt les rongeurs arboricoles de type Funisciurus anerythrus qui sont les plus suspects d’être le réservoir animal du virus9. Les résultats préliminaires des projets précédemment menés en République démocratique du Congo par les équipes impliquées dans PANAFPOX ont permis de mettre en évidence le virus monkeypox au sein de trois différentes familles d’écureuils et de petits rongeurs (Sciuridae, Muridae, Nesomyidae) évoquant un large spectre d’hôtes du virus10.
La prolifération de ces différents rongeurs, suite à la transformation massive des milieux forestiers en milieux agricoles et leur proximité avec l’humain majorent les contacts et les risques de transmission11. Cependant en zone endémique, la même souche virale de monkeypox n’a jamais été isolée chez une paire humain-animal pour affirmer le caractère zoonotique. Et le fait que le virus puisse infecter un large spectre d’espèces ne signifie pas que chaque hôte contribue à la persistance virale, mais tous peuvent contribuer à l’infection humaine. Ainsi, il est important d’identifier les hôtes animaux mais aussi de comprendre l’écologie et les interactions entre ces espèces, et entre les humains et ces espèces dans leur milieu naturel.
Le projet PANAFPOX repose originalement sur la recherche du réservoir animal du virus monkeypox dans les différents pays, à travers à la fois l’analyse rétrospective d’un grand nombre d’échantillons de primates (20 000), de chauves-souris (15 000) et de rongeurs (> 1000) collectés pour d’autres zoonoses (VIH, Ebola, coronavirus, Lassa, paludisme), et également sur des collectes prospectives (rongeurs/écureuils), et la collecte opportuniste de fèces d’animaux sauvages ou péri-domestiques, en zones épidémiques et non épidémiques. La documentation de la distribution et de la diversité du mpox chez les animaux sauvages permettra de prédire avec plus de précision le risque d’émergence chez l’humain.
Les investigations réalisées autour d’épidémies permettront également d’appréhender les types de contacts avec les animaux pouvant être impliqués dans la transmission zoonotique, entamant une réflexion sur l’implication des contacts directs ou indirects dans la transmission zoonotique et interhumaine.
– Documenter la diversité génétique du virus monkeypox
Avant l’épidémie de 2022, très peu de séquences du virus monkeypox étaient disponibles, et peu de travaux sur la phylogénie du virus avaient été réalisés12. Ces aspects sont pourtant fondamentaux : la compréhension d’une zoonose passe par la caractérisation de la diversité virale à l’interface humains/animaux/environnement avec une approche One Health.
Le séquençage prospectif et rétrospectif des souches virales isolées dans les différents pays du projet chez l’humain ou chez l’animal, alimenteront les travaux de phylogénie et phylogéographie éclairant les périodes de divergence des deux clades ou des sous-clades, apportant des informations sur les potentiels réservoirs animaux et les coévolutions virus/animaux, ainsi que sur les liens entre les différentes épidémies, permettant d’évaluer l’importance des échanges transfrontaliers entre les pays des zones étudiées: République démocratique du Congo/République centrafricaine/République du Congo en Afrique centrale et Nigéria/Cameroun/Bénin en Afrique de l’ouest. Ou encore de déceler une éventuelle introduction du clade IIb dans les pays endémiques pour le clade I, suite à l’épidémie mondiale13.
Ces données de séquençage permettront également de discriminer si les différentes épidémies résultent de transmissions zoonotiques itératives et indépendantes, ou de transmissions interhumaines non reconnues, et de l’implication respective de ces deux modes de transmission: principal point aveugle dans l’épidémiologie du mpox en Afrique centrale et au Nigéria.
– Documenter la circulation de la maladie et les formes asymptomatiques de mpox chez l’humain dans les pays endémiques
L’épidémie mondiale de 2022 a suggéré la circulation à bas bruit du mpox chez l’humain, potentiellement de façon non reconnue.
La circulation actuelle réelle du virus en population humaine et animale en zone endémique reste méconnue: y a-t-il une réelle absence de cas dans les pays ne déclarant pas de cas en Afrique? ou des difficultés de surveillance, ou encore des difficultés d’accès au diagnostic biologique? Quelle est l’étendue de l’infection dans les pays endémiques et dans les pays considérés non endémiques? Quelle est l’étendue des infections asymptomatiques et paucisymptomatiques?
Pour répondre à ces questionnements, des études de séroprévalence avec un test sérologique multiplex préalablement développé par l’équipe du projet14 seront menées, permettant d’obtenir un aperçu exact de la circulation en population humaine et animale dans les pays endémiques et non endémiques en Afrique.
Dans les pays comme le Bénin, non endémiques pour le mpox mais ayant déclaré les cas humains à la frontière avec le Nigéria ou avec des liens épidémiologiques avec ce pays, ces enquêtes permettront d’évaluer la circulation effective du virus, et selon le niveau de prévalence retrouvé, l’implication de transferts anecdotiques transfrontaliers ou l’existence d’un réservoir animal ou humain local.
Dans un pays endémique comme la RDC, ces études de séroprévalence menées à la fois dans des zones concernées par des épidémies et des zones sans épidémie, permettront d’éclairer les facteurs de risques différentiels entre ces zones distinctes et in fine de tenter de préciser les sources de l’infection par le virus monkeypox.
L’évaluation de la circulation asymptomatique du virus monkeypox permettra d’affiner les systèmes de surveillance de la maladie, et les critères diagnostiques de cette maladie. Les études de séroprévalence donneront une estimation de l’immunité préalable des populations selon les zones permettant d’évaluer l’extension potentielle/risque de dissémination lors de l’irruption de la maladie, élément particulièrement important pour des pays d’Afrique de l’ouest considérés comme indemnes de la maladie mais frontaliers avec des pays où sévit une épidémie.
La réalisation d’étude sérologique pour le mpox a jusqu’ici été compliquée par la non spécificité des tests sérologiques utilisés et la réactivité croisée avec les Orthopoxvirus ou un antécédent vaccinal contre la variole. Le test sérologique utilisé dans ce projet a été développé par l’équipe de TransVIHMI et l’INRB, à partir de 3 peptides synthétiques présentant des épitopes15 spécifiques au mpox et non présents dans le vaccin16, et permettant de détecter les anticorps relatifs aux deux clades viraux et avec une bonne spécificité versus les autres Orthopoxvirus.
Originalités du projet
Ce projet correspond à la première étude sur le mpox portant à la fois sur l’Afrique centrale et de l’ouest et fédérant les quatre pays impliqués en permettant la comparaison des résultats obtenus grâce à l’utilisation des mêmes méthodes, renforçant les probabilités d’éclairer les zones d’ombre autour de cette zoonose.
La compréhension de cette zoonose à partir de différents environnements en Afrique, depuis les forêts équatoriales d’Afrique centrale jusqu’aux forêts guinéennes ou aux zones de savane, donnera un aperçu des environnements spécifiquement concernés par cette maladie.
Pour la recherche du réservoir animal, des techniques de prélèvements non invasives seront favorisées dans ce projet, qu’il s’agisse de prélèvement de fèces ou de sang séché (dried blood spot). Ces approches indirectes surfèces ont préalablement permis de tracer l’origine zoonotique de différents pathogènes tels que le VIH, ou le paludisme par l’équipe de TransVIHMI et ses partenaires du CREMER et de l’INRB17. La détection de pathogènes sur fèces permet d’évaluer la circulation des agents infectieux tout en étant non invasifs et avec le moins d’impacts écologiques possible sur des espèces parfois en état critique de conservation.
Conclusion
À terme, l’identification du réservoir du virus monkeypox et la compréhension des modes de transmission zoonotique et interhumain du mpox ainsi que l’évaluation de la circulation exacte au sein des populations humaines et animales en zone endémiques, permettra de prévenir les épidémies localement, de définir les mesures de prévention ciblées et adaptées aux épidémiologies locales et d’éviter la diffusion du clade I, plus transmissible et plus létal, en dehors de sa zone d’émergence. Ce projet, en permettant d’identifier les zones prioritairement concernées par le mpox, aura un réel impact sur les politiques de santé publique des pays concernés. De façon générale, ce projet participe au renforcement des capacités de surveillance et d’investigations d’épidémies d’agents infectieux émergents à potentiel épidémique avec une approche One Health, d’importance majeure dans des pays régulièrement sujets à de nombreuses émergences infectieuses zoonotiques.
Références
Adetifa I, Muyembe JJ, Bausch DG, Heymann DL. Mpox neglect and the smallpox niche: a problem for Africa, a problem for the world. Lancet. 2023;401(10390):1822-1824. doi:10.1016/S0140-6736(23)00588-3
Berthet N, Descorps-Declère S, Besombes C, Curaudeau M, Nkili Meyong AA, Selekon B, et al. Genomic history of human monkey pox infections in the Central African Republic between 2001 and 2018. Sci Rep. Déc 2021;11(1):13085.
Bunge EM, Hoet B, Chen L, Lienert F, Weidenthaler H, Baer LR, et al. The changing epidemiology of human monkeypox—A potential threat? A systematic review. Gromowski G, éditeur. PLoS Negl Trop Dis. 11 févr 2022;16(2):e0010141.
Curaudeau M, Besombes C, Nakouné E et al. Identifying the most probable mammal reservoir host for the monkeypox virus based on ecological niche comparison. Viruses 2023, 15(3), 727; https://doi.org/10.3390/v15030727
D’arc M, Ayouba A, Esteban A, Learn GH, Boué V, Liegeois F, et al. Origin of the HIV-1 group O epidemic in western lowland gorillas. Proc Natl Acad Sci [Internet]. 17 mars 2015 [cité 19 août 2022];112(11). Disponible sur: https://pnas.org/doi/full/10.1073/pnas.1502022112
Dubois, M.E.; Hammarlund, E.; Slifka, M.K. Optimization of Peptide-Based ELISA for Serological Diagnostics: A Retrospective Study of Human Monkeypox Infection. Vector-Borne Zoonotic Dis. 2012, 12, 400–409, doi:10.1089/vbz.2011.0779.
Khodakevich L, Szczeniowski M, Manbu-ma-Disu null, Jezek Z, Marennikova S, Nakano J, et al. The role of squirrels in sustaining monkeypox virus transmission. Trop Geogr Med. avr 1987;39(2):11522
Levine RS, Peterson AT, Yorita KL, Carroll D, Damon IK, Reynolds MG. Ecological niche and geographic distribution of human monkeypox in Africa. PLoS One. 2007;2(1):e176. Published 2007 Jan 31. doi:10.1371/journal.pone.0000176Patrono LV, Pléh K, Samuni L, Ulrich M, Röthemeier C, Sachse A, et al. Monkeypox virus emergence in wild chimpanzees reveals distinct clinical outcomes and viral diversity. Nat Microbiol. Juill 2020;5(7):95565.
Mariën J, Laudisoit A, Patrono L, Baelo P, Vredendaal R van, Musaba P, et al. Monkeypox viruses circulate in distantly-related small mammal species in the Democratic Republic of the Congo [Internet]. In Review; 2021 avr [cité 19 avr 2022]. Disponible sur: https://www.researchsquare.com/article/rs-414280/v1
O’Toole A, Neher RA, Borges V et al. Putative APOBEC3 deaminase editing in MPXV as evidence for sustained human transmission since at least 2016. https://www.biorxiv.org/content/10.1101/2023.01.23.525187v1
Rimoin AW, Mulembakani PM, Johnston SC, Lloyd Smith JO, Kisalu NK, Kinkela TL, et al. Major increase in human monkeypox incidence 30 years after smallpox vaccination campaigns cease in the Democratic Republic of Congo. Proc Natl Acad Sci. 14 sept 2010;107(37):162627.